
Слово «кислота» происходит от латинского слова «кислый». Некоторые продукты с нашего стола, к примеру, уксус или лимонный сок, — кислоты. Основание — соединение, химически противоположное кислоте, и при реакции с кислотой дает нейтральное соединение — соль. Растворимые в воде основания называются щелочами. В цитрусовых плодах — грейпфрутах, апельсинах лимонах — содержатся лимонная и аскорбиновая кислоты. Пчелиный яд – кислота. Нейтрализовать её можно основанием. В цитрусовых плодах – грейпфрутах, апельсинах, лимонах – содержится лимонная и аскорбиновая кислоты.
Кислоты содержат атомы водорода (катион) и кислотный остаток (анион). Щелочи содержат атомы металла (катион) и гидрокисильную группу ОН (анион). Это базовые определения.
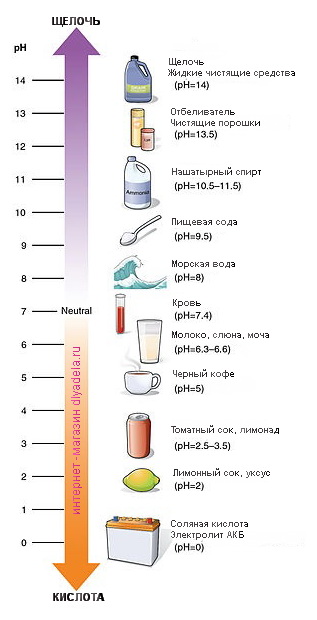
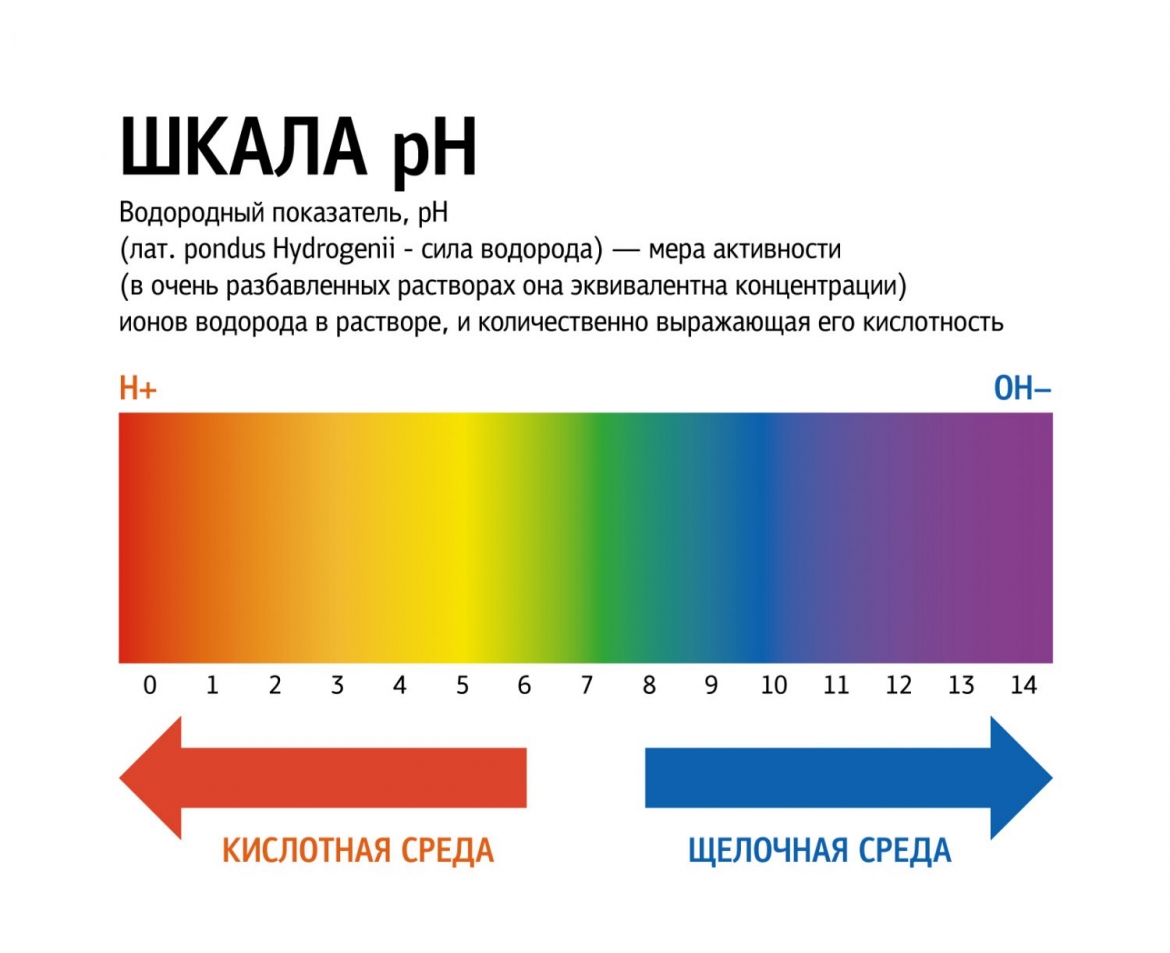
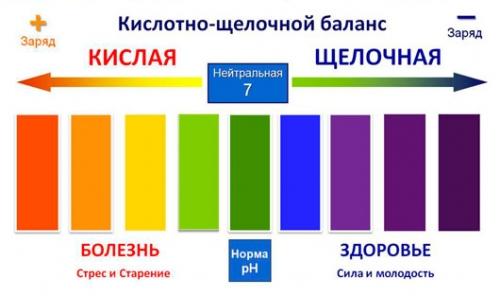
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Кислоты
Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в воде. Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»). Именно ионы придают кислотам их свойства, но существовать они могут только в растворе. Следовательно, свойства кислот проявляются исключительно в растворах. Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор. Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность»Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».
Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.

Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
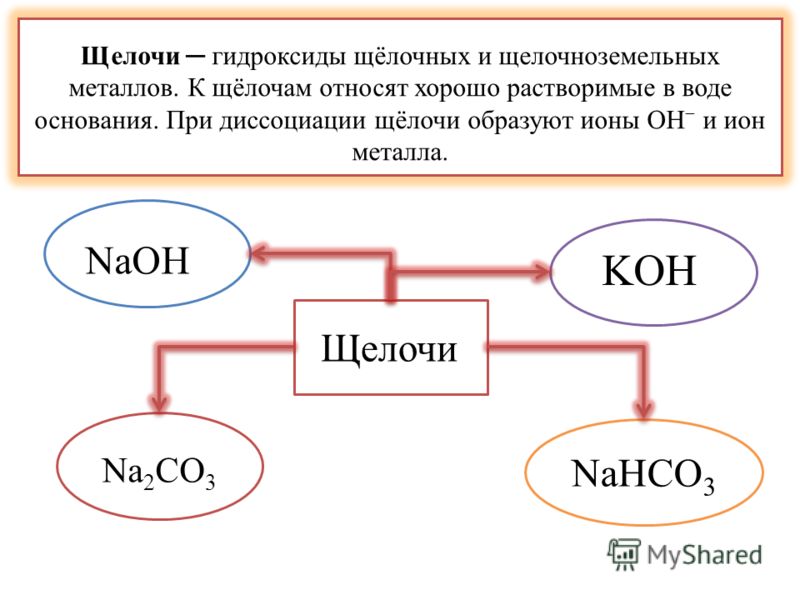
В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов. Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
Едкий натр. Самая популярная и востребованная в мире щелочь. Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия. Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция. Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития. Востребованное соединение в химпроме как сырье; в стекольной, керамической, Фиксаналырадиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария. Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
Есть мнения что:
• Кислоты и щелочи неспособны мирно сосуществовать даже одну секунду, находясь в соприкосновении. Перемешавшись, они мгновенно начинают бурное взаимодействие. Химическая реакция с ними сопровождается шипением и разогревом и длится до тех пор, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам свойственно образовывать кислую среду, а щелочам – щелочную.
• Химики отличают щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.
Источники:
www.polnaja-jenciklopedija.ru/nauka-i-tehnika/kisloti-osnovaniya-schelochi.html
yznavai.ru/kisloty-i-shhyolochi
thedifference.ru/chem-otlichaetsya-kislota-ot-shhelochi
